 2025-03-31
2025-03-31
 0
0
CRISPR筛选结合下一代测序(NGS)技术已成为功能基因组学研究的重要工具,但其成功依赖于CRISPR筛选的诸多环节。从文库质粒的制备到基因组提取,再到PCR扩增方法的选择,每一步的失误都可能导致数据偏差甚至实验失败。本文将从文库质粒质量控制、文库细胞构建对照设置、基因组提取质量优化,以及PCR文库构建方法选择四个关键层面,系统探讨如何保证CRISPR筛选后NGS文库的成功构建。
一、文库质粒质量控制:避免空载体污染
CRISPR文库质粒的纯度是构建高质量CRISPR筛选的基础。空载体污染(未插入sgRNA的质粒)会导致慢病毒中空载体浓度过高,后续测序数据中大量无效序列的干扰可能掩盖真实的筛选结果。
1. 空载体污染的检测
酶切检测:通过构建是否成功文库质粒独一内切酶酶切,电泳检测酶切产物大小。以LentiCRISPRv2载体为例,空载体比含有sgRNA载体大1.5 kb。
测序验证:进行Sanger测序,确认sgRNA插入的正确性,无污染文库会在20 bp sgRNA区域乱峰但其它区域单峰,而污染文库可以看到明显的空载体序列(图1)。
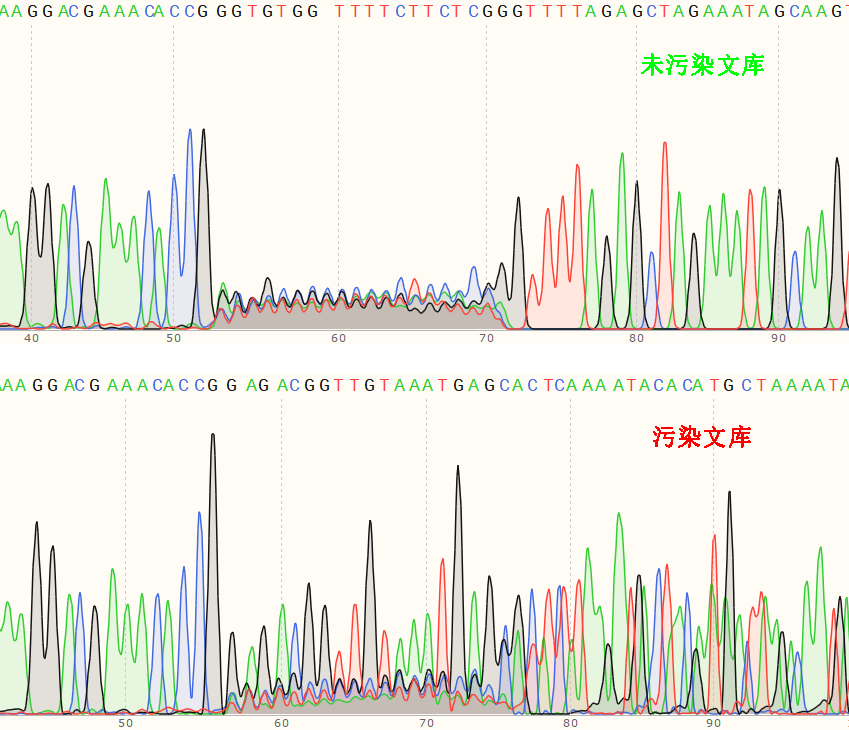
图1 污染的sgRNA文库 Sanger测序图
2. 其它载体污染
其它文库sgRNA污染:因sgRNA文库扩增不严谨,可能混有其它文库sgRNA质粒,这种污染通过空载体污染监测无法排除,需要通过二代测序排除。
其它载体污染:如果被其它含有慢病毒组件的骨架载体污染,通过常用的WPRE-R测序引物可能可以检测到污染源。
研美建议
推荐从Scishare平台(www.scienceshare.cn)购买文库质粒或者从Addgene购买经过我们扩增与质控,可以获得高质量CRISPR文库并排除以上污染。
二、文库细胞构建:设置对照细胞药杀组
CRISPR筛选通常依赖药物压力(如嘌呤霉素,Puro)富集成功转染的细胞,但药物浓度不当或药杀不彻底可能导致假阳性结果。野生型对照的设置是验证CRISPR文库细胞成功构建的关键。
1. 药物浓度梯度测试
在正式实验前,通过梯度实验确定最低有效药物浓度(即杀死所有野生型细胞的Puro浓度)。此外,96孔板、6孔板、10 cm皿和15 cm皿因细胞数量的不同对Puro的反应存在差别,细胞数量越大Puro所需浓度越高。
2. 野生型对照药杀设置
使用未转染sgRNA文库的同源细胞,暴露于相同药物浓度,与sgRNA文库感染组同时进行药杀,以对照组细胞死亡而感染组存活作为是否有效的指针。
研美建议
推荐从研美生物购买Ready-To-Use的文库细胞,也可以委托我们进行文库细胞的构建,我们的Best Cell Pool操作流程可以保证获得高质量文库细胞。
三、基因组提取质量:确保高产量
基因组DNA(gDNA)的质量直接影响后续PCR扩增的效率,尤其是CRISPR筛选依赖的sgRNA扩增步骤需要在较大的覆盖乘数下进行实验,对于60000 sgRNA的全基因组文库,按照300x的覆盖度,需要从1.8*10^7细胞至少获得120 ug gDNA。
1. 提取方法优化
试剂盒选择:针对肿瘤组织或者细胞等不同类型选择适合的提取试剂盒,获得高产量基因组以满足下游扩增。
2. 质量评估标准
纯度检测:Nanodrop测定A260/A280比值(1.82.0为佳),排除蛋白质或酚类污染。
完整性验证:通过琼脂糖凝胶电泳观察gDNA片段(主带>10 kb),避免过度降解。
定量准确性:使用荧光定量法(如Qubit)而非吸光度法,避免RNA或杂质干扰。
研美建议
推荐使用研美生物生产的专为CRISPR筛选优化的基因组提取试剂盒(GK101为酚氯仿抽提法适合肿瘤组织;GK102为柱式提取法适合细胞)。
四、PCR文库构建方法选择:一步法与两步法
sgRNA的扩增通常需通过PCR富集目标区域,一步法与两步法的选择需权衡效率与偏好性风险。
1. 方法对比
一步法PCR:直接使用携带测序接头的引物扩增目标sgRNA区域。
优点:操作简单、耗时短、污染风险低。
缺点:长引物可能引入引物自扩增二聚体,可通过电泳切胶排除。
两步法PCR:首轮扩增sgRNA区域,次轮添加测序接头。
优点:接头添加更灵活,引物合成成本低。
缺点:步骤繁琐,交叉污染风险增加,过度扩增容易发生。
2. 优化策略
循环数控制:一步法建议≤25循环,两步法首轮≤15循环,次轮≤10循环,以减少非特异性扩增。
高保真酶选择:使用包含Proofreading的高保真聚合酶降低错误率,且扩增能力要强。
研美建议
推荐使用研美生物生产的一步法CRISPR筛选测序文库构建试剂盒(PK201适合LentiCRISPRv2;PK202适合LentiGuide-Puro)。
五、总结
CRISPR筛选文库的成功构建需系统性把控每个环节:从质粒纯化排除空载体,到细胞实验中设置严格的野生型对照;从基因组提取的严格质控,到PCR方法的合理选择。未来,文库构建流程或进一步简化,但实验设计的严谨性与细节优化始终是数据可靠性的基石。



