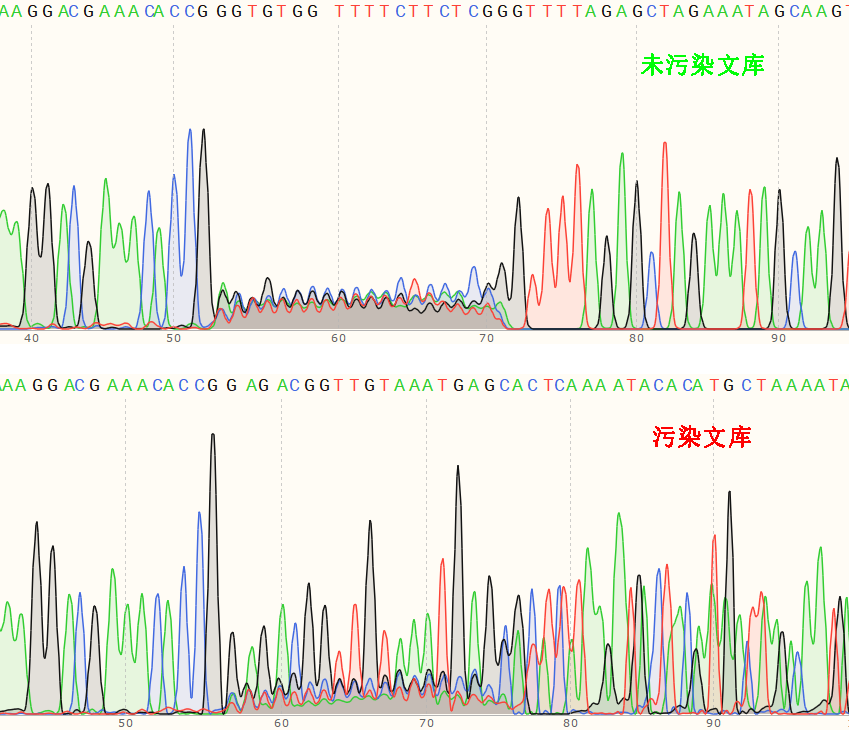
CRISPR筛选结合下一代测序(NGS)技术已成为功能基因组学研究的重要工具,但其成功依赖于CRISPR筛选的诸多环节。从文库质粒的制备到基因组提取,再到PCR扩增方法的选择,每一步的失误都可能导致数据偏差甚至实验失败。本文将从文库质粒质量控制、文库细胞构建对照设置、基因组提取质量优化,以及PCR文库构建方法选择四个关键层面,系统探讨如何保证CRISPR筛选后NGS文库的成功构建
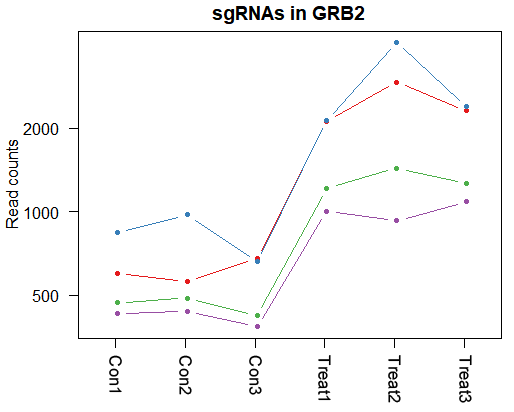
CRISPR筛选后的高通量测序分析是获得关键功能基因的重要的步骤,通过分析实验组和对照组之间sgRNA的富集或者丢失情况,可以清晰了解哪些基因功能受到干预后可以产生研究者感兴趣的表型。研美生物的CRISPR文库筛选分析报告主要是基于MAGeCK分析获得结果进行了可视化以及初步的解读,但是对于初次接触CRISPR筛选甚至对高通量测序本身不熟悉的人来说,要想充分理解报告的内容通常会遇到很多疑问。今天,

CRISPR筛选技术通过高通量敲除或激活基因,系统性研究基因功能与表型的关系。慢病毒因其高效整合和稳定表达的特性,成为递送sgRNA文库的首选载体。然而,在实验设计中,浓缩慢病毒(如通过超速离心或PEG沉淀提高病毒滴度)可能引入多重技术风险。本文将详细探讨其背后的科学原理、实验偏差来源及替代方案,以期为研究者提供全面的技术指导。 我们来看看张锋团队于2017年发表于Nature Protoc

目前,尽管以分子功能,信号通路甚至全基因组等定义的通用性文库已经具有广泛的应用,但是构建适合自身课题研究方向的个性化文库仍是非常重要的。作为普通的科研工作者来说,设计一个个性化的文库仍面临多种选择的焦虑:从头设计sgRNA?还是基于已发表的文库来构建sgRNA?在此,我们就这个问题简单的进行讨论。

构建严格定义的细胞膜蛋白文库面临显著挑战,主要源于蛋白质亚细胞定位的动态性与多重性。以免疫检查点蛋白PDL-1为例,传统认知中其定位于细胞膜,但实验证据表明该蛋白同时分布于细胞膜、核质及细胞骨架系统(图1)。此现象提示:单一亚细胞定位的绝对划分在生物学层面具有局限性。
业务咨询:
售前客服
